独占期与定价是激励中国新药价值实现的关键因素
目前对创新药激励政策的现状是“推动”型激励到位,但“拉动”型激励有待完善。前者的作用是降低研发风险和投入,或者的作用是增加获利预期,为研发者提供足够大的想象空间。
生物医药产业,用短期眼光看,在经历寒冬。但从长远来看,这是一个永远的朝阳产业。
中国“十三五”“十四五”规划中,生物医药都是国家优先发展的战略性产业。从国际市场看,生物医药也是其国际战略的必争之地,美国、欧洲、日本都是如此。
2015年中国药审改革以来,改变了医药行业以仿制药为主的研发与产业发展逻辑,向着原始创新的方向进发,目标是在2030年建成制药强国。
创新药企的数量增多,涌入该领域的资金也在同步增加。从结果来看,本土药企IND申请的数量已经赶超跨国药企在华的数量,在NDA批准数量上也呈现相同的趋势。研发投入也在逐年增加,从一项针对欧盟的全球2500强研发投入公司排名来看,2014年,中国仅有19家医药与生物制造企业入榜。到2022年,这一数量已经达到79家,且有4家进入医药与生物制造领域TOP50。
但医药创新发展至今,也出现了一些结构性问题,这其中有来自创新药企自身能力的因素,也有政策层面的因素,当然也有来自资本层面的影响因素。因此如何从投资角度去评价创新药的价值,并从政策生态的未来发展方向上判断影响创新药价值的变量,成为政策制定者、创新药企、投资机构需要去关注的重点。
净现值模型一般用来评估投资标的未来的价值,净现值可以理解为获利预期,简单来讲,在产品上市前,其净现值是负数,随着产品上市后的商业化,净现值也会逐渐提升。当有一时刻,投入与产出的达到“0”的临界点时,意味着产品开始盈利。但不是所有产品都能够盈利。
四要素内涵
那什么会影响一个创新药达到“0”的临界点,并开始盈利呢?从我们的分析来看,在国内,至少有四方面的因素会对此产生影响。
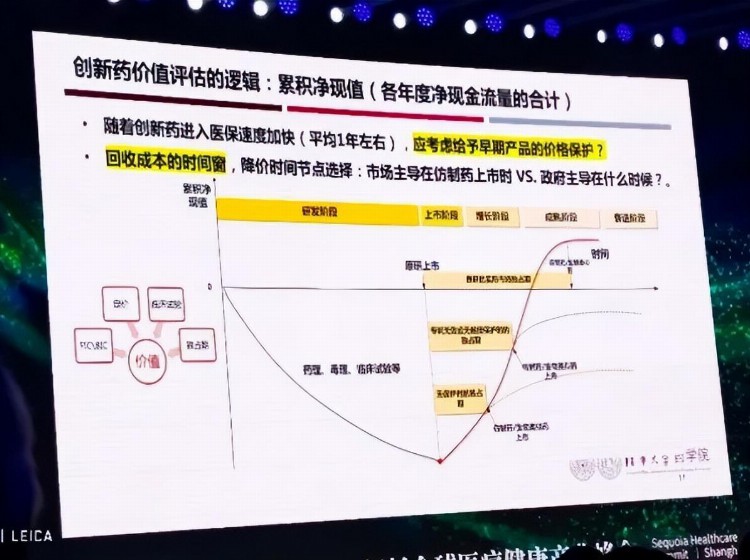
首先是对产品价值的界定,属于是FIC还是BIC,这主要取决于科学家对自身技术的认知,也取决于审评机构基于审评管理的判断。如果没有产品价值的初始分类原则,在前期立项时,大家一窝蜂地上马类似的项目,那么在产品上市后,就很难区分出差异化价值。此外,这一因素还会影响后面三个因素的施展空间。
第二是临床试验效率。临床试验费用与时间,占去前期研发投入绝大部分比例,若是时间缩短、效率提升,那么相对的研发成本降低,而盈利时间会提前。
第三和第四分别是独占期与定价。这两个因素要放在一起说,按照国际惯例,独占期越长,自主定价空间越大,收回成本的时间就会越短。
独占期与定价
是激励中国新药价值实现的关键因素
从以上四方面因素来看中国创新药目前的政策与产业生态,呈现出3方面的现状。
首先是在激励政策上,因为激励政策决定了净现值模型后面曲线是平缓还是陡峭。我认为,目前激励政策的现状是“推动”型激励到位,但“拉动”型激励有待完善。
“推动”型激励是保障性激励,包括基础研究创新基金、临床试验资助、税收抵扣、加速批准等,其作用是降低研发风险和投入,但是没有为研发者提供未来足够的市场获利空间;“拉动”型激励包括市场独占期保护、市场定价、医保支付等,其作用是增加获利预期,可以为研发者提供足够大的想象空间。
“拉动”型激励以“独占期”为核心。但是国内企业往往对“独占期”有一些错误的理解,认为“独占期”的设立会影响后续同技术赛道的产品上市。事实上,并非如此。创新药的“独占期”在各个国家有差异化的设计。在美国,因为其对NCE与NBE的界定比较严格,其鼓励地是原始创新。这与美国所处的创新程度相关,比如,美国从2015年到2021年批准的323个新分子实体中,FIC数量占比为39%,达到125个,而我国同期批准的60个新分子实体中,FIC的占比仅为10%,有6个。
所以不同的创新程度对“独占期”影响的范围有所不同。比如从欧盟、日本、韩国来看,他们不仅鼓励原始创新,更加鼓励改良型创新。换句话说,制度设计上可以在鼓励具有临床价值的改良创新是否受“独占期”的影响方面进行差异化设计。
2023年,NMPA已经将《中华人民共和国药品管理法实施条例》列入立法计划,意味着今年在实施条例中会对此前所提及的数据保护6年期限、罕见病7年独占期、儿药12个月独占期再次进行明确。先不讨论具体的时间限定是否合理,但一旦写进去,会对创新药产业带来“拉动”型激励。
在激励政策上另外一个关键因素是定价和医保支付的关系。虽然药价谈判以来,医保局在持续细化药价谈判的流程,稳定产业界对新药进入医保时的价格降幅预期。但是从本质上而言,目前医保谈判的定价逻辑仍然是以可及性的目标去要求创新药的价格。国际上通行的做法,一般是先有新药,然后再考虑可及,但现阶段的药价谈判是将二者混在了一起,既要有药,又要可及。
所以我认为,在新药的医保准入上,可以给创新药一定的价格保护期,在没有仿制药或者同类药物进入市场时,让其定价机制有一定的灵活性,为早日进入“净现值模型”曲线的盈亏平衡点确立一个明确的“拉动”型激励预期。
这也涉及到第二个观点,目前我国在创新药的界定上未区分价值。2017年新的药品注册管理分类,对中国1类新药的定义调整为全球新,但就像上面提及的数据,中国获批上市的FIC占比非常低。因此,NCE与NBE有创新价值,但其本质上是对药理学机制作用的创新,但在实际临床应用中,改良型创新,也就是BIC也非常有价值。从这个角度出发,是否也可以对创新做一个基于价值的区分。
E8R1带来的临床挑战
第三个观点是接下来国内临床试验管理趋势将呈现出更加规范、严谨下的适度灵活。
2017年NMPA加入ICH,并随后成为管委会成员,意味着ICH指导原则的落地过程中,国内临床试验管理将越来越与国际接轨。
截止2023年4月7日,国家药品审评中心共发布了183个临床研究指导原则,接近美国FDA发布的指南数量,覆盖从人体药理学研究、探索性临床研究和确证性临床研究,对提高我国临床研究水平发挥了重要的作用。
在ICH指导原则E系列里,有一个非常重要的临床指导原则是《E8:临床试验的一般考虑》时隔25年,E8完成了第一次修订,预计E8R1将在今年7月31日转化应用。我认为E8R1将会对国内临床试验整体产生非常重要的影响。
这主要体现在全球药品监管层面,对临床设计原则的系统思考。其中显性的改变是体现在临床分期上,临床药物开发常被分为四个阶段,也就是常说的I期临床、II期临床、Ⅲ期临床、IV期临床,而《E8(R1):临床研究的一般考虑》对临床研究的类型描述有点不一样,按研究目的进行分类:弱化临床分期,代之以人体药理学、探索性、确证性、批准后为研究类型划分。
这对国内创新药企的临床试验方案设计能力提出更好的要求。抗肿瘤药 是审评加速机制最多的治疗领域,未来应当关注支持批准上市的关键性临床试验证据要求的变化,总体趋势是与国际证据规则一致,对于附条件批准的药品,增加上市后确证性证据的要求。
新药研发,未来可期
医药产业的特点是为了人类健康服务,虽然现在正在经受着因资本、政策、产业内卷等带来的挑战,但长远来看,新药研发,未来仍值得期许。
总结来看,作出一个具有全球竞争力的产品,药企需要从以下两方面提升自身能力。
首先是提高新药临床价值判断能力,这一条非常关键。因为在现行政策中,对新药临床价值的官方界定、评估和分类是缺失的,比如医保药价谈判,缺少临床价值评估这个环节,而直接进入到药物经济学的可及性的语境中。因此,药企在立项阶段要对目标研发项目的临床价值界定前置,医保谈判定价也应建立客观的临床价值评估方法,先于药物经济学评价开展,对临床价值高的产品采取更为适宜的创新支付策略,不采用一刀切谈判定价模式。
其次是药企要提前准备临床试验管理的规范化和灵活性,需要研究国际规则。因为未来的临床试验管理是一定要跟国际规则接轨的。不能仅关注国内指南,更要研究ICH指南,要打造自身满足和符合国际通用要求的能力。比如上面提及的关键临床试验在设计上的要求等。
对投资者而言,需要尤其关注“独占期”和医保药价谈判这两项政策接下来可能会发生的变化,这可能是催化接下来新药投资冷暖的关键影响因素。目前来看,“独占期”具有明确性,已经写入了《实施条例》征求意见稿,未来的变化无非是保护范围的界定和“独占期”时间长短的问题。
最后,我要说,所有医药人与相关利益方,需要对政策深入研究、正确理解和合理把握,生物医药产业是全球战略必争之地,中国生物医药产业不仅是为满足国内需求,更是为满足国际需求。创新药的市场需求没有真正释放,尚处于某种抑制状态,因此,不要过度地产生悲观的预期,相信中国医药产业创新有一个非常好的未来。
本文根据清华大学药学院药品监管科学研究院院长杨悦在第三届红杉全球医疗健康产业峰会的演讲内容整理,原题为“以临床价值为导向的鼓励创新药政策影响与展望”。


